![네오이뮨텍 CI. [네오이뮨텍 제공]](https://cdn.financialpost.co.kr/news/photo/202404/204209_205555_3853.jpg)
바이오 기업 네오이뮨텍의 주가가 주식시장에서 강세로 마감했다. 대표 신약 후보 물질인 ‘NT-I7(efineptakin alfa)'의 병용 임상ㆍ비임상 시험 결과에 대한 포스터를 공개한다는 소식이 영향을 준 것으로 풀이된다.
25일 코스닥시장에서 네오이뮨텍은 전 거래일보다 17.93% 보다 오른 1651원에 거래를 마쳤다. 장중 한때 1818원까지 치솟으며 상한가에 근접하기도 했었다.
네오이뮨텍은 내달 31일부터 오는 6월 4일까지 미국 시카고에서 개최되는 '2024 미국임상종양학회(American Society of Clinical Oncology)'에서 NT-I7의 병용 임상ㆍ비임상 시험 결과에 대해서 3건의 포스터를 선보일 예정이다.
T 세포 증폭제인 NT-I7은 암세포과 감염 세포를 제거하는 T 세포를 생성시키고 기능을 극대화 시키는 신약 후보 물질이다. 면역항암제 '키트루다'를 보유한 글로벌 제약사 머크와 후속 논의를 통해 NIT-110 임상시험의 췌장암과 MSS 대장암 환자 군에 추가로 각각 24명과 25명의 환자를 추가로 모집해 임상시험을 진행한 바 있다.
이번 포스터 발표를 통해 췌장암 환자 총 48명과 MSS 대장암 환자 총 50명에게 NT-I7과 키트루다를 병용 투여한 결과를 최초로 설명한다.
아울러 췌장암과 MSS 대장암 환자의 NT-I7과 키트루다를 병용 투여한 결과에 대한 바이오 마커 분석 결과도 함께 공개한다.
오윤석 네오이뮨텍 대표이사는 "네오이뮨텍의 주요 임상시험의 중간 결과를 발표하게 돼 기쁘다"며 "NT-I7의 T세포 증폭 효능을 통해서 췌장암과 MSS 대장암 환자들의 삶이 개선된 결과를 확인했다"고 말했다.
이어 "현재까지 확인한 NT-I7의 T세포 증폭 효능 데이터를 토대로 가장 빠르게 NT-I7이 허가 받을 방법을 마련하려고 노력할 것"이라고 강조했다.
![[파이낸셜포스트 그래픽]](https://cdn.financialpost.co.kr/news/photo/202404/204209_205556_4432.jpg)
지난 15일 네오이뮨텍은 유럽 시장에서 본격적인 임상을 시작하기 위한 준비 작업으로 이사회에서 폴란드 법인 설립을 결의했다. 유럽의약품청(EMA)에서 바이오의약품 등 개발 지원 프로그램을 활용할 방침이다.
네오이뮨텍 관계자는 "다양하게 진행 중인 미국 임상시험과 더불어 유럽 시장에서도 좀 더 효율적이고 효과적으로 확장해 품목허가 일정을 앞당기고자 이번 폴란드 법인 설립을 계획했다"며 "설립을 계기로 좀 더 빠른 제품 개발 속도는 물론 경제적 효과도 클 것"이라고 설명했다.
네오이뮨텍 폴란드 법인이 유럽 중소기업(SME, small and medium sized enterprise)으로 지정된다면 EMA로부터 개발 프로그램 전반에 걸친 혜택을 제공받을 수 있다.
혜택에는 △의약품 승인을 위한 규제 지침 제공 △행정·절차적 지원 △희귀 의약품에 대한 프로토콜 개발 지원 △수수료 감면·면제 등 직접적인 재정적 지원도 포함된다.
아울러 EMA가 운영하는 우선 심사 대상 의약품(Priority Medicines, PRIME) 자격을 획득하는데 유리한 조건을 가질 수 있다.
PRIME은 미충족 의료 수요(Unmet Medical Needs)가 있는 영역이나 기존 치료법에 비해 효과가 뛰어날 것으로 기대되는 의약품에 부여되고 있다. 조기부터 강화된 과학과 규제 지원을 제공하며 판매 승인까지 걸리는 시간을 단축해 주기도 한다.
PRIME 제도의 혜택은 치료 옵션이 없고 환자 수가 적은 희귀질환 치료제에 주로 주어지는 것으로 알려졌다.
 [특징주] 아진엑스텍, 삼성ㆍLG 로봇사업 강력 드라이브에 국내 유일 모션제어 구축 주목
[특징주] 아진엑스텍, 삼성ㆍLG 로봇사업 강력 드라이브에 국내 유일 모션제어 구축 주목 [종목이슈] 모나리자, 가파른 상승세 묻지마 투자?…"주가 상승 원인불명"
[종목이슈] 모나리자, 가파른 상승세 묻지마 투자?…"주가 상승 원인불명" [특징주] 알에스오토메이션, 세계 최소형 로봇 4축 제어 드라이브 출시…반도체 웨이퍼 천장이송장비에 독점적용 초읽기
[특징주] 알에스오토메이션, 세계 최소형 로봇 4축 제어 드라이브 출시…반도체 웨이퍼 천장이송장비에 독점적용 초읽기 [종목이슈] 와이씨, 삼성전자와 대규모 공급계약 소식에 연일 폭등세
[종목이슈] 와이씨, 삼성전자와 대규모 공급계약 소식에 연일 폭등세 [특징주] GST, SK하이닉스 신규 팹 'M15X' 20조 투자 "AI 메모리 공급 핵심으로"…차세대 냉각 기술 보유 수혜주↑
[특징주] GST, SK하이닉스 신규 팹 'M15X' 20조 투자 "AI 메모리 공급 핵심으로"…차세대 냉각 기술 보유 수혜주↑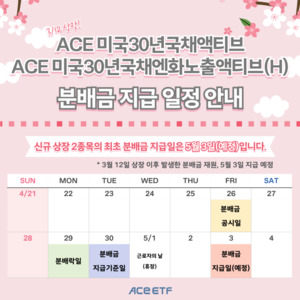 한투운용, 美 30년국채 투자 ACE ETF 2종 첫 분배금 지급…"26일까지 매수해야"
한투운용, 美 30년국채 투자 ACE ETF 2종 첫 분배금 지급…"26일까지 매수해야"

